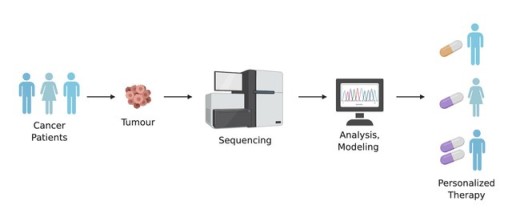
Laikai, kai visoms ligoms gydyti buvo naudojamas kraujo nuleidimas – seniai praeityje. Tačiau net ir modernūs gydymo metodai dažnai neatitinka individualių žmonių poreikių. Tačiau į kovą su itin retomis, įgimtomis ligomis ar tradiciniu būdu nepagydomu vėžiu jau stoja personalizuota medicina – naujausiųjų biotechnologijų, mašininio mokymosi ir „panomikos“ pagalba.

Asociatyvi „Pixabay“ nuotr.
Sužinoti kiekvieno iš mūsų unikalų genomą, kiekvieną mūsų požymius koduojančią raidę, jau toli gražu ne mokslinė fantastika. Net nuo 2003-iųjų, kai buvo užbaigtas Žmogaus genomo projektas, ir pirmą kartą nusekvenuotas žmogaus genomas, pasikeitė labai daug. Šiais laikais, nuskaityti visą Jūsų genetinę informaciją užtruktų vos kelias dienas, ir kainuotų keletą tūkstančių eurų. O šiame kode slepiasi ir visos Jūsų įgimtų ar įgytų ligų paslaptys.
Didieji duomenys, padedantys išgydyti vėžį
Vos prieš kelis metus įkurtos Precizinės medicinos iniciatyvos Indianos universitete direktorius, dr. Anantha Shekhar, jau gali papasakoti ne vieną, praktiškai „stebuklingą“ personalizuotos medicinos sėkmės istoriją.
Dar pirmaisiais iniciatyvos gyvavimo metais, tyrėjai susidūrė su vos šešerių metų paciente, besiskundžiančia pilvo skausmu. Po išsamių tyrimų paaiškėjo, jog tai itin retos formos kiaušidžių vėžys.
Pagal „standartinį“ vėžio gydymo protokolą, mergaitei – Emai – buvo taikoma chemoterapija. Tačiau šis gydymas nepadėjo, liga išplito, o prognozė buvo itin bloga – likusios daugiausia šešios savaitės. Vis dėl to, mergaitės gydytojai nusprendė nusekvenuoti vėžinių ląstelių genomą.
Paaiškėjo, jog vėžinės ląstelės turi tam tikrą mutaciją, būdingą daug rūkantiems, plaučių vėžiu sergantiems žmonės. Nors šis rezultatas be galo nustebino, atsirado kelias personalizuotai terapijai.
Emai pritaikytas specifinis gydymas – visai neseniai sukurtas vaistas plaučių vėžiui gydyti. Vos po aštuonių savaičių Emos vėžys visiškai prapuolė. Mergaitė grįžo į mokyklą, kaip sveikas ir gyvenimu besidžiaugiantis vaikas.
Tokių sėkmės istorijų tiek Indianos universitete, tiek kitur pasaulyje jau ne viena. Kas gi tas vienas žingsnis tarp beviltiškos diagnozės ir „stebuklingo“ išgijimo? Gebėjimas sužinoti ir suprasti duomenis, užkoduotus mūsų pačių genome.
Kiekviena mūsų ląstelė savyje slepia genetinę informaciją – per 30 tūkst. genų, užkoduotų daugiau nei trijuose milijarduose raidžių sekoje. Jei paverstume šį „teksto“ kiekį į knygas, jos sudarytų 130 stambių tomų smulkiomis raidėmis! Tai – be galo didelis informacijos kiekis.
Prieš beveik 20 metų mūsų genomas buvo pilnai „perskaitytas“ pirmą kartą, tačiau vien nustatyti visai genomo raides užtruko virš 10 metų. Šiais laikais tai padaryti galime gerokai greičiau, ir kiekvieno žmogaus unikalų genomą „nuskaityti“ vos per kelias dienas. Tačiau kas iš to?
Įsivaizduokite, jog turite peržiūrėti 130 knygų tomų, palyginti ją su kitų žmonių genomų knygų tomais, ir rasti mažiausias klaideles kažkur tame trijų milijardų raidelių derinyje. Su tokiu informacijos kiekiu gali susidoroti tik kompiuteris. Todėl kuriami ir tobulinami mašininio mokymosi algoritmai, gebantys nustatyti genomo „klaidas“ ir užvesti tyrėjus ir medikus ant kelio ieškant atsakymų bei personalizuotų gydymo būdų.
Nuo nežinomos diagnozės iki pirmojo itin retos ligos atvejo
Pasaulyje jau veikia ne viena tokia iniciatyva. Personalizuota medicina skinasi kelią ne tik į laboratorijas, bet visų gydytojų kasdienę praktiką. Po truputį imama suprasti, jog kiekvienas pacientas ir atvejis gali būti unikalus – kiekvieno paciento imtis yra N =1.
Genomo analizė gali padėti atskleisti ir iki tol nematytas, pasauliui visiškai naujas ligas. Taip nutiko ir, pavyzdžiui, su NGLY1 nepakankamumo sutrikimu. Šios genetinės ligos atvejų pasaulyje nustatyta mažiau nei 50, o ji pati buvo pirmą kartą apibūdinta tik 2012-aisiais. Ir tai padaryti padėjo būtent genomo tyrimai.
Retomis ligomis sergantys žmonės, ypač įgimtus sutrikimus turintys vaikai, dažnai metų metus praleidžia be konkrečios diagnozės. Standartiniai testai po vieną atmeta įvairiausias ligas, o specialistai siunčia pacientą vieni pas kitus. Į pagalbą čia taip ateina genomo tyrimai.
Taip nutiko ir pirmajam NGLY1 nepakankamumo pacientui – Bertrand Might, kuriam jau 6 mėnesių amžiaus buvo nustatyti vystymosi sutrikimai, bei keletas labai neįprastų simptomų, pavyzdžiui, tai, jog akyse visada nesigamina ašaros. Tik po 4 metų, daugybės įprastų tyrimų bei specialistų konsultacijų, o galiausiai – vieno išsamaus genomo tyrimo paaiškėjo, jog dėl šių simptomų greičiausiai kalta paveldėta dviguba NGLY1 geno mutacija.
Pasiaiškinus šio geno koduojamo baltymo funkciją diagnozė pasidarė dar aiškesnė – Bertrand būklę lėmė tai, jog organizmo ląstelės negeba apsivalyti nuo netinkamų ląstelės baltymų ir jų perdirbti, todėl atsiranda visas pluoštas specifinių NGLY1 nepakankamumui būdingų simptomų.
Diagnozė – pirmas žingsnis į informuotą ligos gydymą. Tačiau personalizuotos medicinos vaidmuo ties diagnoze toli gražu nesibaigia. Nors kol kas NGLY1 nepakankamumas nėra išgydoma liga, naujausios biotechnologijos naudojamos įvairiems naujiems vaistams testuoti ant NGLY1 neturinčių ląstelių iš kiekvieno konkretaus paciento. Taip galima atrasti vaistus, kurie padeda sumažinti būtent to paciento simptomus, užuot visiems taikant identišką gydymą. Vis dėl to, net to paties geno mutacija gali sukelti labai skirtingų simptomų skirtinguose individuose.
Ne tik genomika: naujausios technologijos padeda suprasti smulkiausius molekulinius mūsų organizmo procesus
Personalizuota medicina remiasi ne tik genomika, tačiau ir proteomika (visų organizme gaminamų baltymų tyrimas), transkriptomika (genetinės informacijos „vertimas“, kad būtų galima ląstelėje gaminti reikiamus baltymus), metabolomika (visų organizmo metabolinių reakcijų analizė) ir t. t., kartu vadinama „panomika“.
Šių technologijų pagalba galima tiksliau suprasti ne tik kiekvieno žmogaus genotipą, bet ir jo fenotipą – tai, kas vyksta organizmo viduje, iki smulkiausių molekulių ir procesų.
Nors aptinkant tam tikras genų mutacijas įmanoma nustatyti retą ligą ar specifinį vėžio tipą, organizme vykstantys procesai yra daug sudėtingesni ir daugialypiai. Ta pati mutacija gali labai skirtingai pasireikšti, nesutapti pacientų simptomai ir t. t. Tai reiškia ir tai, jog vienam tinkamas gydymas nebūtinai tiks kitam.
Taigi personalizuotai medicinai būtina studijuoti ne tik kiekvieno paciento genomą, bet ir tai, kokie baltymai, nukleorūgštys, lipidai gaminami jo organizme, kaip visos šios medžiagos sąveikauja. Iš tiesų, kiekvienoje mūsų ląstelėje vykstantys procesai sudaro milžinišką tarpusavyje sąveikaujantį tinklą, o jam studijuoti reikalingos ir sistemų biologijos technologijos.
Pagrindinė panomikos įdėja – užuot studijavus mūsų kūną „dalimis“, pažvelgti į visumą, atrasti sąsajas ir surinkti kuo daugiau duomenų apie smulkiausius molekulinius procesus ir gaminamas molekules.
Tam, žinoma, neapsieinama be kompiuterinių technologijų, tokių kaip mašininis mokymasis. Žmogui tokį informacijos kiekį apdoroti ir iš jos pasidaryti prasmingas išvadas nebūtų įmanoma.
Pavyzdžiui, 2014-aisiais pradėta GLOBAL klinikinių tyrimų programa siekia nustatyti specifinius ligų „pirštų antspaudus“ analizuojant ateroskleroze sergančių ir sveikų pacientų genomus, epigenetinius (nuo aplinkos priklausančius) procesus, proteomą – visus organizme gaminamus ir veikiančius baltymus, metabolizmo procesus ir kt. Manoma, jog supratus, kaip siejasi genomo ir kitų „omų“ pokyčiai organizme, būtų galima tiksliau diagnozuoti įvairias ligas. Į GLOBAL programą įtraukti 7 500 žmonių.
Įdomu tai, kad nors kai kurioms ligoms gali būti būdingos daugybė genetinių mutacijų, kartais šios mutacijos lemia daug mažiau baltymų gamybos pokyčių nei būtų galima tikėtis. Tuo tarpu sistemiškai analizuojant visų ligos sukeliamų pokyčių amplitudę, būtų galima atrasti daug tikslesnių biomarkerių – specifinių molekulių ir procesų – ligai diagnozuoti, bei tiksliau nuspėti, kokią terapiją taikyti.
Planuojama, jog GLOBAL programa sugeneruos virš 22 trilijonų duomenų taškų. Vien lyginant su mūsų genome užkoduota informacija, tai – nesuvokiamai didelis duomenų kiekis. Vieno žmogaus genomas sudarytų 130 knygų tomų, o čia planuojama gauti dar keliais milijonais kartų didesnį kiekį duomenų!
GLOBAL ir kitų panašių panomikos programų duomenims analizuoti kuriami ir tobulinami specialūs kompiuteriniai algoritmai, kurie gebės sistematiškai išanalizuoti duomenis, ir atrasti tam tikrus sutapimus, modelius, suteikiančius daugiau žinių apie specifinių ligų „profilius“.
Supratus, kad ne tik kiekvienas pacientas, bet ir kiekviena liga kiekvienu unikaliu atveju gali turėti specifinį „kodą“, bendra medicinos praktika po truputį keisis į personalizuotos medicinos pusę. Užuot kiekvienam taikant tą patį, standartizuotą gydymą, bus galima daug anksčiau nustatyti ir nuspėti, kokio specifinio gydymo ir vaistų kiekvienam pacientui reikia.
Žinoma, jog tai paspartins ir sparčiai besivystančios biotechnologijos, kurių pagalba nustatyti žmogaus genomą, proteomą ir kitus „omus“ darosi vis paprasčiau, greičiau ir pigiau. Tačiau ir, neišvengiamai tobulėjantys kompiuteriniai algoritmai, padėsiantis itin greitai apdoroti milžiniškus iš panomikos tyrimų gaunamus duomenis, ir medikui rekomenduoti geriausia gydymo kryptį.
 Panašiai atrodanti liga, to paties tipo vėžinis susirgimas nebūtinai reiškia, jog visiems pacientams tiks tas pats gydymas. Personalizuotas ir efektyvesnes gydymo strategijas nuspėti gali padėti panomika ir gautų duomenų analizė kompiuteriniais algoritmais. © Jeyang259 (CC BY-SA 4.0) | commons.wikimedia.org |
|---|
Sutikite – ateina didelių pokyčių metas, kuris, tikėkimės, padės kiekvienam iš mūsų gauti tik mums tinkamą gydymą, atpažinti dar nežinomas ligas, bei išgydyti kol kas neišgydomas. Tokias kaip tam tikrų tipo vėžys, Alzheimerio liga, amiotrofinė lateralinė sklerozė (ALS) ir kiti neurodegeneraciniai sutrikimai, bei kitos kol kas neįveikiamos ligos, kamuojančios žmones, bendruomenes ir visą sveikatos apsaugos sistemą.
Šaltiniai:
- The Future of Medicine is Personal | Anantha Shekhar | TEDxIndianaUniversity
- Cancer: The genetic cure in Indiana
- One of a Kind
- Being an accidental pioneer in precision medicine | Matt Might | TEDxBirmingham
- „The Algorithm for Precision Medicine“
- Voros, S., Simon, R., Kalogeropoulos, A., CARDIoGRAMplusC4D Consortium et al., McRae, Swanton, ... & Brooks, J. (2014). The Promise of Panomics: Decoding Biological Networks to Identify Pathways Involved in Complex Diseases. Clinical OMICs, 1(5), 22-24.


 Laikai, kai visoms ligoms gydyti buvo naudojamas kraujo nuleidimas – seniai praeityje. Tačiau net ir modernūs gydymo metodai dažnai neatitinka individualių žmonių poreikių. Tačiau į kovą su itin retomis, įgimtomis ligomis ar tradiciniu būdu nepagydomu vėžiu jau stoja personalizuota medicina – naujausiųjų biotechnologijų, mašininio mokymosi ir „panomikos“ pagalba.
Laikai, kai visoms ligoms gydyti buvo naudojamas kraujo nuleidimas – seniai praeityje. Tačiau net ir modernūs gydymo metodai dažnai neatitinka individualių žmonių poreikių. Tačiau į kovą su itin retomis, įgimtomis ligomis ar tradiciniu būdu nepagydomu vėžiu jau stoja personalizuota medicina – naujausiųjų biotechnologijų, mašininio mokymosi ir „panomikos“ pagalba.