Svoriai kinta, elementai keičia vietas, ramybės neduoda reliatyvumas – svarbiausia chemijos mokslo lentelė toli gražu nėra stabili, ir niekas nežino, kuo visa tai baigsis.
Jei imitavimas yra nuoširdžiausia pagyrų forma, periodinė lentelė turi daugybę tikrų gerbėjų. Šriftai, mėsos rūšys ir netgi Muppetai buvo išdėlioti pagal jos atvaizdą. Chemikai, elemento vietos lentelėje ir jo kaimynų žinojimas tebėra patikimiausias elemento savybių indikatorius – ir vertingas naujų medžiagų paieškos vedlys. „Tvarkos sudarymo iš chaoso prasme, ji lenktyniauja su Darwino Origin of Species“, – sako Peteris Edwardsas iš Oxfordo universiteto.
Periodinės lentelės ištakos siekia XIX a., kai chemikai pastebėjo, kad išrikiavus žinomus cheminius elementus pagal atominę masę, išryškėja tam tikra struktūra. Septintajame užpraeito amžiaus dešimtmetyje, Dmitrijus Mendelejevas ir kiti ėmė grupuoti elementus į eilutes ir stulpelius, norėdami šią struktūrą atspindėti – ir suvokė, kad plyšiai gautose lentelėse leidžia nuspėti tada dar nežinomų elementų egzistavimą.
Tik su kvantų teorijos atsiradimu XX a. imta pamažėle suvokti, kas slypi už šios struktūros. Periodinės lentelės eilutės ir blokai daugmaž atspindi, kaip atomo elektronai išsidėstę „sluoksniuose“ apie protonus branduolyje. Elektronai užpildo sluoksnius ir pasluoksnius, pradėdami nuo turinčio mažiausią energiją ir esančio arčiausiai branduolio. Elektronų skaičius tolimiausiame sluoksnyje, ir jo atstumas nuo branduolio ir kitų sluoksnių yra pagrindiniai chemines elemento savybes apibrėžiantys veiksniai. „Cheminis periodiškumas yra natūrali savybė“, – sako Ericas Scerri'is, chemijos filosofas iš Kalifornijos universiteto Los Angelese.
Bet tikriausiai būtent dėl to ir darome kai kurias skubotas išvadas apie lentelę. „Žmonės mano, kad viskas jau žinoma. Tačiau taip nėra – dar reikia išsiaiškinti daugybę, daugybę aspektų“, – sako Scerri'is. Elektronų konfigūracijos nevisada gerai atitinka chemines savybe. Savybė ir struktūra, kurią laikome savaime suprantama Žemėje, visiškai kitokia ekstremalioje kosmoso aplinkoje. Ir nemažai apie tai, kas vyksta lentelės gale – o ir kur tas galas yra – lieka neatsakyti klausimai. Kaip išvysite toliau pateikiamuose pavyzdžiuose, periodinė lentelė tebėra vykstantis darbas…
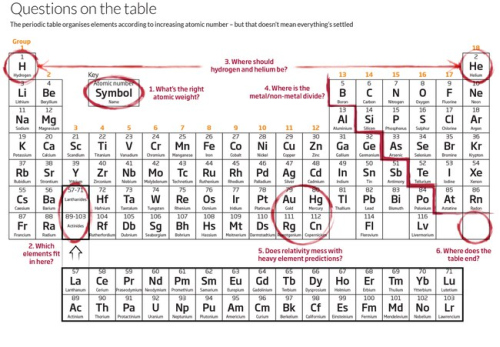
Svorių afera
Pirmosiose periodinėse lentelėse elementai būdavo išrikiuojami pagal didėjančią atominę masę – iš esmė, pagal protonų ir neutronų skaičių branduolyje. Bet daugelis atomų turi izotopus, kurių branduoliai skiriasi neutronų skaičiumi. Dabartinėse lentelėse elementai išrikiuojami pagal atominį skaičių – nekintantį protonų skaičių.
Atominė masė tebėra – bet kyla klausimas, kuri iš jų yra „teisinga“? Anksčiau ji būdavo rodoma kaip vienas skaičius, imant natūralių izotopų masių vidurkį ir atsižvelgiant į jų gausą. Bet tai palaikomas neteisingas manymas, kad šis skaičius yra kažkokia fundamentali konstanta, teigia Tyleris Coplenas iš Restono Stabilių izotopų laboratorijos Virdžinijos valstijoje. Iš tiesų, elemento, tarkime, anglies, atominė masė šiek tiek skiriasi, priklausomai nuo to, koks tiksliai kiekvieno izotopo yra pavyzdyje.
2009 m. lentelės sergėtojai, Tarptautinė teorinės ir taikomosios chemijos sąjunga (International Union of Pure and Applied Chemistry – IUPAC), ėmėsi veiksmų, pašalindama nustatytas atomines mases 10 elementų, tarp kurių vandenilis, litis, boras, anglis, azotas ir siera, pakeisdami juos masių spektru, parodančiu izotopų pasiskirstymą visuose žinomuose žemiškuose pavyzdžiuose. 2013 gegužę atėjo bromo ir magnio eilė. Kiti tikriausiai bus nikelis, selenas ir cinkas.
Tačiau ne visi elementai į savo masę žiūri taip lengvabūdiškai. Fluoras, aliuminis, natris, auksas ir dar 17 kitų elementų turi tik vieną stabilų izotopą, tai reiškia, kad jų atominė masė yra pastovi iš prigimties. Tad jų masės gali likti.
Trys – jau kompanija?
Dėliojant elementus periodinėje lentelėje pagal atominį skaičių, jų vieta tampa neginčijama – išskyrus tada, kai ginčijama. Paimkime dvi elementų eilutes, lyg paskutiniu momentu susizgribus pridėtas po pagrindine lentele: lantanidus ir aktinidus.
Du tarpai pagrindinėje lentelėje, po skandžiu ir itriu 3 grupėje, žymi vietas, kur turėtų įsiterpti tos dvi juostos. Tačiau kyla klausimas, kaip jas įterpti? Yra dvi minties mokyklos. Viena vadovaujasi elektronų konfigūracija: tiek skandis, tiek itris išoriniame sluoksnyje turi po tris elektronus, kaip ir lantanas ir aktinis, kairiausi šių serijų elementai, tad jie visai teisėtai užima savo vietas. Bet kiti nurodo, kad pagal chemines savybes, atominį spindulį ir lydymosi temperatūrą geriau tinka liutecis ir laurencis dešiniame eilutės gale. 2008 m., įtampa tarp dviejų pusių išsiliejo „Journal of Chemical Education“ puslapiuose.
Disputo sprendimas svarbus, sako Scerri'is, ir ne tik vardan pedagoginio aiškumo. Itris gali būti naudojamas superlaidininkų, išlaikančių savybę praleisti srovę be varžos gana aukštoje temperatūroje, gamybai. Vyksta medžiagų, turinčių panašių savybių, medžioklė ir Scerri'is mano, kad liutecis ir laurencis gali būti nepakankamai vertinami, nes atrodo priklausantys kitai, visiškai nesusijusiai grupei.
Bet koks sprendimas įvyks dar negreit. IUPAC leido Scerri'iui sudaryti komitetą – bet tik tam, kad išsiaiškintų, kam tokio sprendimo gali reikėti.
Pusiau tuščia ar pusiau pilna?
Ankstyvojoje visatoje praktiškai tebuvo du paprasčiausi elementai, vandenilis ir helis. Bet randantis sudėtingesniems elementams, darėsi sudėtinga nuspręsti, kur jie tinka. „Panašu, lyg klaustume, kaip reikia klasifikuoti dinozaurus drauge su visais kitais gyvūnais“, – palygino Scerri'is.
Vandenilio atome yra vienas protonas, gaubiamas elektronų sluoksnio, kuriame yra venas elektronas, nors telpa du. Tai ar sluoksnis pusiau tuščias ar pusiau pilnas? Dauguma elementų cheminėse reakcijose pasiima arba atiduoda elektronus. Vandenilis gali veikti dvejopai, kartais prisijungdamas elektroną, kad užpildytų sluoksnį ir sudarytų tokius junginius kaip natrio hidridas (NaH), o kartais vienintelį elektroną prarandą ir sudaro tokius junginius, kaip vandenilio fluoridas (HF).
Daugumoje periodinių lentelių, taip pat ir IUPAC, vandenilis dedamas pirmojoje grupėje, drauge su elektronus atiduodančiais metaliniais elementais, tokiais, kaip litis ar natris. Bet netgi IUPAC leidžia vandeniliui taip pat patogiai įsitaisyti prie elektronų trokštančių halogenų, tokių, kaip fluoras 17 grupėje. Daugumos chemikų toks nevienareikšmiškumas itin nejaudina. „Nematau bėdos įtraukti vandenilį ir į It doesn't bother me to include hydrogen both in group 1 and in group 17“, ir grupę, sako Pekka Pyykkö iš Helsinkio universiteto Suomijoje.
Tuo tarpu su heliu bėda, kad dėl užpildyto išorinio sluoksnio jis praktiškai su niekuo nereaguoja. Standartinėje periodinėje grupėje. Bet kadangi jo išoriniame sluoksnyje tėra du elektronai, kai kam atrodo, kad jam tinkamesnė vieta būtų šalia tokių elementų, kaip berilis, 2 grupėje.
Šį įtarimą stiprina skaičiavimai, rodantys, kad ir helis, ir neonas tam tikromis sąlygomis gali reaguoti su kitais elementais, bet helis – labiau. Tai prieštarauja reaktyvumo stiprėjimo leidžiantis žemyn grupe, tendencijai – kai kas siūlo tai ištaisyti, perkeliant helį į grupę.
Kada metalas nėra metalas?
Periodinės lentelės sudarymo pionieriams pasitikėjimo atliekamo darbo teisingumu suteikė tendencija, kad einant įstrižai nuo apatinio kairio kampo į viršutinį dešinį, elementai tampa mažiau metališki. Paprastai jas skirianti linija vaizduojama, kaip stora linija, laiptais besileidžianti nuo lentelės dešinės.
Gaila, tačiau tai nėra taip paprasta. „Metalo, nemetalo riba nėra šventas dalykas“, – sako Edwardsas. Tarkime, vandenilis. Mes, žemiečiai, laikome jį visiškai nemetališkomis, skaidriomis dujomis. Bet vandenilio turtingų planetų, tokių, kaip Jupiteris ar Saturnas gelmės, aukštas slėgis temperatūra, manoma, paverčia vandenilį blizgančiu, metaliniu skysčiu. Įprastinė jo vieta periodinėje lentelėje virš metalinio ličio, tai ir rodo. Bet tokie pagarsėję nemetalai, kaip helis ar deguonis, spaudžiami, manoma, taip pat keičia prigimtį ir jų išoriniai elektronai laigo laisvi, ir elektrą praleidžia, kaip tinkami. „Jūsų išmokta periodinė lentelė tėra normalių sąlygų periodinė lentelė“, – pastebi Friedrichas Henselis ir Marburgu universiteto Vokietijoje.
Slegiamas vandenilis gali netgi virsti kietu metalu, medžiaga, su tokiu jaudinančiu pritaikymu, kaip kuras ar kambario temperatūros superlaidininkas – nors neseni teiginiai apie jo pagaminimą laboratorijoje diskutuotini.
Bet yra ir neabejotinų faktų. 2009 metais Artemo Oganovo, dabar dirbančio Niujorko valstijos universitete Stony Brooke, vadovaujama komanda panaudodami aukštą slėgį, pavertė blizgų 1 grupės metalą natrį skaidriu, rausvai oranžiniu nemetalu. Šiuo atveju slėgis suartino elektronus taip, kad šie turėjo persigrupuoti idant sumažintų tarpusavio stūmą, užuot lakstę laisvi.
Toks elgesys rodo, kad chemijos pasaulyje nedaug pastovumo, tačiau nereikėtų panikuoti, sako Oganovas. „Nemanau, kad periodinę lentelę reikėtų revizuoti. Tai, ką darome dabar, yra tiesiog labai svarbūs jos komentarai ir pataisymai.“
Einšteino įtaka
Einšteino reliatyvumas kraipo erdvę, laiką, protus – ir periodinę lentelę. Prisiartinus prie aukso, kurio atominis skaičius yra 79, branduolio trauka yra jau tokia stipri, kad arčiausiai esantys elektronai zvimbia apie jį greičiu, prilygstančiu 80 % šviesos greičio. Tai padidina jų masę, tad jie sukasi arčiau branduolio ir uždengia tolesnius elektronus nuo jo traukos. Todėl išoriniai sluoksniai išsiplečia – ir tvarkingas ryšys tarp to, kaip elektronai užpildo sluoksnius ir elemento cheminių savybių ima irti.
Būtent iš čia atsirandantys poveikiai aukso sugeriamos šviesos bangų ilgiui lemia tai, kad auksas toks nepanašus į virš jo periodinėje lentelėje esančius brangiuosius metalus. „Tam, kad auksas skirtųsi nuo sidabro, reikia reliatyvumo“, – sako Pyykkö. Ir tai ne vienintelis atvejas. Tik pernai Peteris Schwerdtfegeris Massey universitete, Aucklande, Naujojoje Zelandijoje, galiausiai įrodė tai, kas buvo įtariama kelis dešimtmečius: kad gyvsidabrio anomaliai žema lydymosi temperatūra, dėl kurios jis vienintelis kambario temperatūroje yra skystas, taip pat yra dėl reliatyvistinių efektų.
O kas vyksta, prie lentelės pridedant vis sunkesnius elementus? Nesame tikri. Kai rezerfordžio (atominis skaičius 104) ir dubnio (105) savybės pasirodė besiskiriančios nuo tiesiai virš jų esančių hafnio ir tantalo, kilo klausimų. Bet siborgis (106) atrodo visiškai pritampantis. Elementas 107 buvo pavadintas „nuobodžiuoju boru“ dėl pritapimo prie grupės. Eksperimentai su dviem lentelės naujokais, kopernikiu (112) ir flevoriumu (114), kol kas piešia maišytą vaizdą.
Tai Einšteinas iš lentelės atėmė prognozavimo galias? Pyykkö dėl netvarkos nesijaudina. „Nėra paprastos matematinės teorijos, pagrindžiančios periodinę lentelę, – sako jis. – Yra daug varžtelių ir sraigtelių – vienas iš jų yra reliatyvumas. Sudėti kartu, jie paaiškina periodinės lentelės veikimą.“ Matthiasas Schädelis, tiriantis supersunkius elementus GSI Helmholtz Sunkiųjų jonų tyrimų centre Darmstadte, Vokietijoje, ne toks optimistiškas. „Periodinė lentelė tebėra nepažeista – bet tikslių savybių prognozuoti negali“, – sako jis.
Kur visa tai baigsis?
Pirmieji atomų modeliai rodė, kad virš atominio skaičiaus 103, teigiamai įelektrintų protonų tarpusavio stūma taps tokia stipri, kad atomai paprasčiausiai suirs. Gamtos duota eilė iš esmės baigiasi su 92, uranu.
Bet dėl laboratorijose vykstančių eksperimentų, stengiantis sukurti elementus už urano, dabar oficialiai pripažintas atomas yra livermoriumo (116). Elementai 117 ir 118, jau sukurti, kol kas dar nėra įteisinti. Aišku, kad lentelės pabaigą nustatyti nėra taip paprasta. „Riba tikrai yra, – sako Schädel. – Bet nežinome, kur.“
Supersunkių elementų, kurių atominis kaičius didesnis, nei 103 egzistavimą aiškina teorijos, teigiančios, kad lygiai, kaip elektronai yra išsidėstę sluoksniais, taip ir protonai bei neutronai. Kai jų skaičius yra lygus arba artimas „magiškiems“, atitinkantiems užpildytus sluoksnius, atomai būna stabilesni. Bet vis vien turi būti taškas, kai masyviuose atomuose esantis laukas taps nebepakeliamas. Pagal vieną pasiūlymą, 2011 m. iškeltą fizikos teoretiko Paulo Indelicato'o iš Pierre ir Marie Curie universiteto Paryžiuje ir jo kolegų, šių laukų kvantinis nestabilumas galiausiai pribaigtų elementus, kurių atominis skaičius didesnis, nei 172.
Tačiau kalbant apie supersunkius elementus, stabilumas šiaip ar taip yra reliatyvus dalykas: kol kas pagamintieji yra radioaktyvūs ir dažnai išlieka vos dalelę sekundės prieš suirdami, taip apsunkindami jų tyrimą. Be to, daugumą jų gali pagaminti tik po vieną atomą iš karto, o tai reiškia, kad cheminės ir fizikinės savybės – garavimas, laidumas, ar tai yra dujos, skystis ar kieta medžiaga, – praktiškai netenka prasmės. Tad, ar jie iš vis laikytini elementais? „Chemikai nori pamatyti chemines sąveikas“, – sako Schädelis.
Keletas tyrimų komandų sukūrė genialius vieno atomo savybių tyrimo būdus. Viename eksperimente buvo tiriamas kopernikio ir flevoriumo lakumas, lyginant temperatūras, kurioje atomas prilimpa prie aukso paviršiaus, su žinomo lakumo atomų. Teorija taip pat numato, kad aukštesnė prilipimo temperatūra gali būti metališkumo požymis. „Chemikai ir fizikai šimtmečiais nustatinėdavo metališkumą, bet jiems niekada nereikėjo galvoti, kas nutinka su vienu atomu, – sako Schädelis. – Tai visiškai naujas metalo nustatymo būdas.“
Net jeigu ir taip, jei nėra realių perspektyvų kam nors panaudoti šiuos supersunkius elementus, ar tai nėra tuščias laiko švaistymas? Schädelis taip nemano, ir laiko tokius eksperimentus tąsa 150 metų tradicijos, padariusios periodinę lentelę tokiu charizmatišku elementų sąrašu, koks jis dabar yra. „Tai terra incognita žvalgymas, ėjimas į vietas, kur anksčiau niekas kitas nė nežvilgtelėjo“, – sako jis.


 Svoriai kinta, elementai keičia vietas, ramybės neduoda reliatyvumas – svarbiausia chemijos mokslo lentelė toli gražu nėra stabili, ir niekas nežino, kuo visa tai baigsis. Jei imitavimas yra nuoširdžiausia pagyrų forma, periodinė lentelė turi daugybę tikrų gerbėjų. Šriftai, mėsos rūšys ir netgi Muppetai buvo išdėlioti pagal jos atvaizdą. Chemikai, elemento vietos lentelėje ir jo kaimynų žinojimas tebėra patikimiausias elemento savybių indikatorius – ir vertingas naujų medžiagų paieškos vedlys.
Svoriai kinta, elementai keičia vietas, ramybės neduoda reliatyvumas – svarbiausia chemijos mokslo lentelė toli gražu nėra stabili, ir niekas nežino, kuo visa tai baigsis. Jei imitavimas yra nuoširdžiausia pagyrų forma, periodinė lentelė turi daugybę tikrų gerbėjų. Šriftai, mėsos rūšys ir netgi Muppetai buvo išdėlioti pagal jos atvaizdą. Chemikai, elemento vietos lentelėje ir jo kaimynų žinojimas tebėra patikimiausias elemento savybių indikatorius – ir vertingas naujų medžiagų paieškos vedlys.